Come trovare il numero di protoni, elettroni e neutroni
Autore:
Roger Morrison
Data Della Creazione:
27 Settembre 2021
Data Di Aggiornamento:
1 Luglio 2024

Contenuto
- stadi
- Parte 1 Calcola il numero di protoni, elettroni e neutroni
- Parte 2 Calcola il numero di elettroni in uno ione
Neutroni, elettroni e protoni sono le tre particelle principali che compongono un atomo. Come puoi immaginare, i protoni hanno una carica positiva, gli elettroni portano una carica negativa e i neutroni sono solo particelle neutre. La massa di elettroni è molto piccola. Tuttavia, i neutroni e i protoni hanno masse simili. Per trovare il numero di protoni, elettroni e neutroni di un atomo, è sufficiente consultare la tavola periodica degli elementi, detta anche tabella di Mendeleev.
stadi
Parte 1 Calcola il numero di protoni, elettroni e neutroni
-
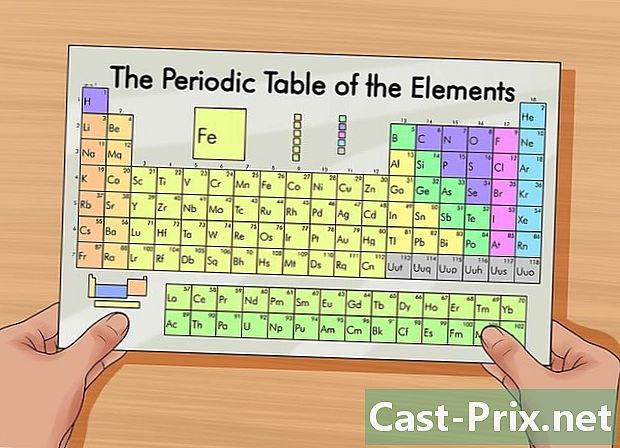
Ottieni una tabella periodica degli articoli. Questa tabella ti aiuterà a trovare il numero di protoni, elettroni e neutroni in un elemento. È una tabella che presenta gli elementi in base alla loro struttura atomica. Un codice colore distingue i diversi elementi. Ogni elemento è identificato da un simbolo composto da una, due o tre lettere. La tabella mostra anche altre informazioni come la massa atomica e il numero atomico di ciascun elemento.- Puoi trovare questo grafico facendo una ricerca su Internet o in un libro di chimica.
- Durante gli esami, ti sarà normalmente consentito utilizzare una tavola periodica degli elementi.
-
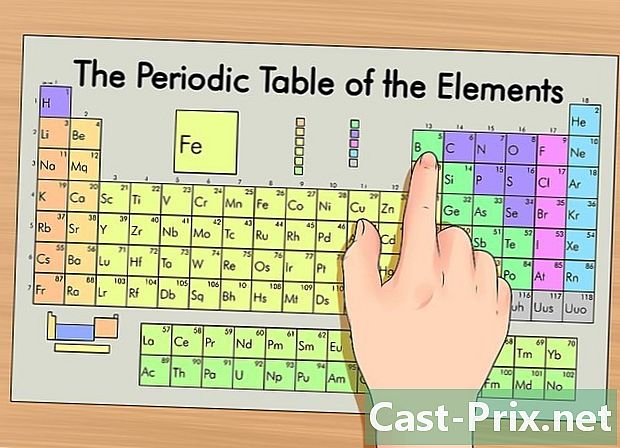
Identifica il tuo elemento nella tavola periodica. Nella tabella, gli elementi sono raggruppati in base al loro numero atomico. Sono divisi in tre gruppi principali: metalli, non metalli e metalloidi (semi-metalli). Altri gruppi includono metalli alcalini, alogeni e gas nobili.- È più facile individuare un elemento nell'array usando il suo gruppo (colonna) o punto (riga).
- Se non conosci le proprietà dell'elemento, puoi cercare il suo simbolo.
-
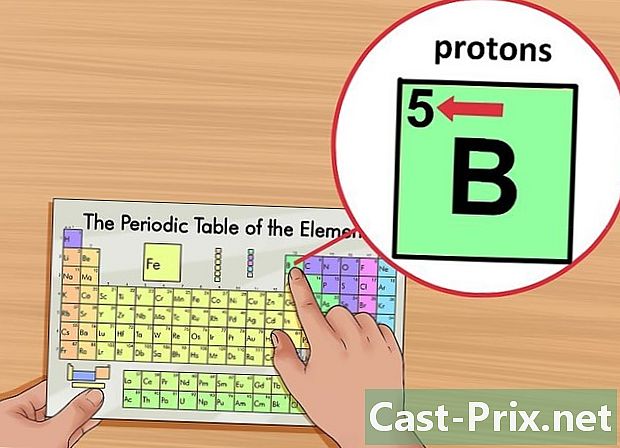
Individua il numero atomico dell'elemento. Questo numero è contrassegnato nell'angolo in alto a sinistra della casella, sopra il simbolo dell'elemento. Il numero atomico ti dà il numero di protoni che compongono l'elemento in questione.- Ad esempio, il numero atomico di boro (B) è 5. Quindi, ha 5 protoni.
-

Determina il numero di elettroni. Il nucleo di un atomo include protoni che sono particelle cariche positivamente. Gli elettroni sono particelle cariche negativamente. Pertanto, il numero di protoni ed elettroni di un elemento neutro sarà lo stesso.- Ad esempio, il boro (B) ha un numero atomico di 5, quindi ha 5 protoni e 5 elettroni.
- Tuttavia, se si tratta di uno ione positivo o negativo, il numero di protoni e il numero di elettroni saranno diversi. Dovrai calcolarli. La carica del leone è indicata in caratteri piccoli da un esponente dopo l'oggetto corrispondente.
-

Cerca la massa atomica dell'elemento. Questo passaggio ti permetterà di trovare il numero di neutroni. Dovrai prima determinare la massa atomica o il peso atomico dell'elemento. Questo dato rappresenta la massa media degli atomi di questo elemento. È inscritto sotto il simbolo dell'elemento.- Assicurati di arrotondare la massa atomica dell'elemento al numero intero più vicino. Pertanto, il boro ha una massa atomica di 10.811, ma dovrai rotolare a 11.
-

Fai la differenza tra il numero atomico e la massa atomica. Per calcolare il numero di neutroni, è necessario differenziare tra il numero atomico e la massa atomica. Non dimenticare che conosci già il numero atomico. È semplicemente identico a quello dei protoni.- Per il boro avrai: 11 (massa atomica) - 5 (numero atomico) = 6 neutroni
Parte 2 Calcola il numero di elettroni in uno ione
-

Trova la carica elettrica di uno ione. Questo numero appare dall'esponente dopo il simbolo dell'elemento. Uno ione è un atomo con una carica positiva o negativa dovuta all'aggiunta o alla soppressione di elettroni. Il numero di protoni in un atomo non varia. Tuttavia, in uno ione, il numero di elettroni viene modificato.- Poiché un elettrone ha una carica negativa, diventa positivo dopo la rimozione di uno o più elettroni. D'altra parte, l'aggiunta di elettroni avrà l'effetto di rendere negativa la carica.
- Ad esempio, il carico di N è -3. D'altra parte, quello di Ca è +2.
- Non dimenticare che questo calcolo non è necessario, se il simbolo dell'elemento non è seguito da un esponente.
-

Rimuovi la carica dal numero atomico. Inizialmente, uno ione con una carica positiva è un atomo che ha perso elettroni. Per trovare il numero di elettroni, devi sottrarre le cariche aggiuntive dal numero atomico. Se il leone è positivo, il numero di protoni è maggiore di quello degli elettroni.- Ad esempio, la carica di Ca è +2. Di conseguenza, ha perso 2 elettroni rispetto al suo stato iniziale. Il numero atomico del calcio è uguale a 20, quindi il leone ha 18 elettroni.
-

Aggiungi una carica al numero atomico di ioni negativi. Quando uno ione viene caricato negativamente, il latome ha elettroni extra. Per calcolare il numero totale di elettroni, è sufficiente aggiungere il numero di cariche aggiuntive al numero atomico. Se il leone è negativo, ha meno protoni dell'elettrone.- Ad esempio, il carico di N è -3. Quindi, trasporta 3 elettroni in più rispetto al suo stato iniziale. Il numero atomico di lazote è 7. Pertanto, questo ione ha 10 elettroni.

